El desarrollo de un programa de tecnovigilancia es crucial para garantizar la seguridad y el correcto funcionamiento de los dispositivos médicos en las instituciones de salud. A continuación, compartimos una guía práctica para ingenieros biomédicos que puede ser valiosa para implementar o mejorar un programa de tecnovigilancia en tu institución, basado en las directrices del INVIMA y las necesidades de los profesionales biomédicos. ¡Esperamos que te sea de utilidad!
Paso 1
Definir el alcance del programa de tecnovigilancia
- Objetivo: monitorear y evaluar continuamente la seguridad y eficacia de los equipos biomédicos.
- Equipos involucrados: es importante determinar los dispositivos médicos de alto riesgo en tu institución, priorizando aquellos más utilizados en procedimientos críticos o que involucren mayor riesgo para el paciente.
- Regulaciones aplicables: considera las normativas del INVIMA, como la Resolución 4816 de 2008 y las guías internacionales que garanticen la correcta tecnovigilancia de tus equipos médicos..
Paso 2
Identificación de actores clave
- Ingenieros biomédicos: son los principales responsables del seguimiento técnico de los dispositivos médicos.
- Personal médico y de enfermería: colaboran en la identificación de incidentes adversos y en el manejo operativo de los dispositivos.
- Fabricantes e importadores: es necesario que estén involucrados en la gestión de reportes de incidentes adversos, en el suministro de información técnica y en el mantenimiento de los dispositivos.
- Comité de tecnovigilancia: es recomendable crear un comité que incluya profesionales de varias áreas (mantenimiento, compras, calidad) para la toma de decisiones y coordinación de actividades de tecnovigilancia.
Paso 3
Implementación de herramientas para la recolección de datos
- Sistema de Reporte de Incidentes Adversos: utiliza un software que te permita reportar eventos adversos de manera rápida y eficiente. Este sistema debe ser accesible para todos los actores y cumplir con las normativas del INVIMA. Nuestro software QS, te permite enlazar tu estrategia de mantenimiento con el reporte interno de eventos adversos en tu institución de una forma ágil y sencilla.
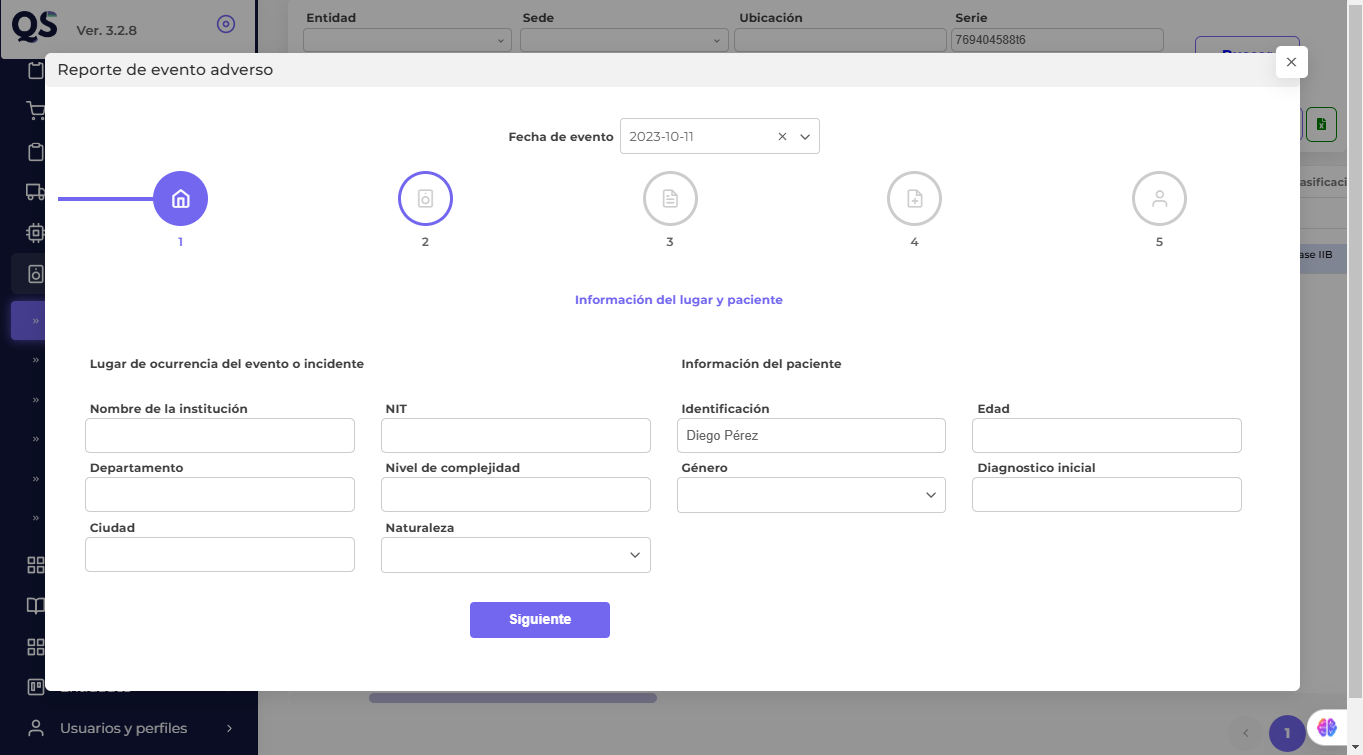
- El módulo de reporte de eventos adversos en el CMMS de QS para clínicas y hospitales permite la captura, registro y seguimiento de eventos e incidentes adversos asociados con el uso de equipos biomédicos. Basado en estándares de tecnovigilancia, el módulo organiza los reportes en secciones clave, incluyendo datos de identificación del paciente, detalles del dispositivo involucrado, descripción del evento, clasificación según su gravedad, y gestión de acciones correctivas.
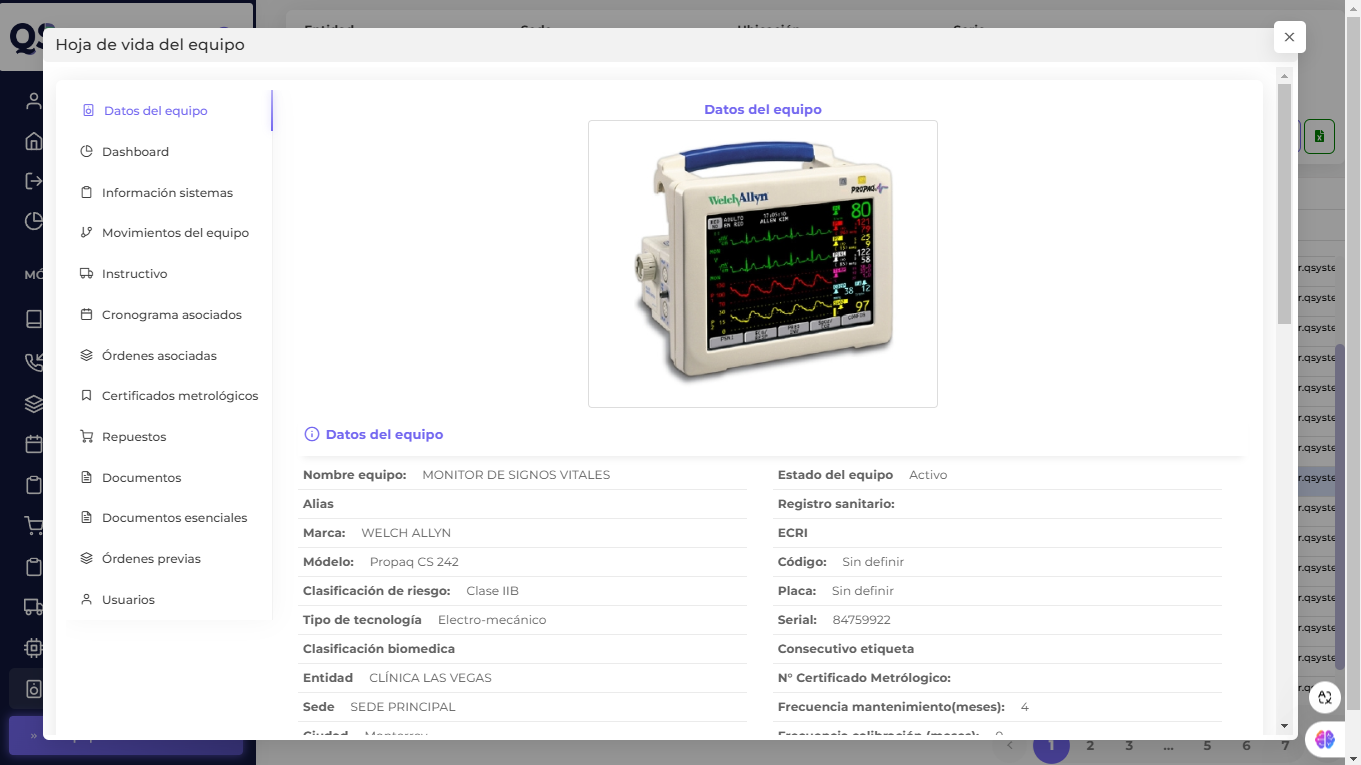
- Seguimiento de la Trazabilidad: los ingenieros biomédicos deben mantener un registro detallado del ciclo de vida de los dispositivos, desde su adquisición hasta su disposición final, asegurando que cada paso cumpla con las normas de seguridad.
- Nuestro software QS te proporciona toda la trazabilidad completa y la validación del cumplimiento de todos los aspectos técnicos y regulatorios durante toda su vida útil.
- Capacitación Continua: asegúrate de que todo el equipo humano involucrado esté capacitado en la identificación y reporte de eventos adversos.
Paso 4
Proceso de Identificación y Evaluación de Riesgos
- Evaluación de Incidentes Adversos: establece criterios claros para determinar la gravedad y el impacto de los eventos adversos en los pacientes.
- Análisis de Causas Raíz: los ingenieros biomédicos deben trabajar en conjunto con el comité de tecnovigilancia para investigar las causas detrás de los fallos o mal funcionamiento de los equipos.
- Planes de Acción Correctiva y Preventiva (CAPA): desarrolla e implementa medidas correctivas para mitigar los riesgos identificados, y medidas preventivas para evitar que los incidentes se repitan.
Paso 5
Comunicación con el INVIMA y Otras Autoridades
- Reporte de Incidentes al INVIMA: los ingenieros biomédicos deben asegurarse de que todos los eventos adversos sean reportados al INVIMA de manera oportuna, siguiendo las guías establecidas por la entidad.
- Alertas Internacionales: mantente al tanto de alertas internacionales sobre dispositivos médicos para ajustar el programa de tecnovigilancia según sea necesario.
Paso 6
Monitoreo Continuo y Mejora del Programa
- Auditorías Internas: realiza auditorías periódicas para evaluar la efectividad del programa de tecnovigilancia y hacer ajustes según sea necesario.
- Indicadores de Desempeño: implementa indicadores para medir el impacto del programa en la reducción de riesgos, la gestión de eventos adversos, y la mejora en la seguridad de los dispositivos médicos.
- Actualización de Procedimientos: adapta el programa conforme evolucionen las normativas y las tecnologías biomédicas.
Paso 7
Involucrar a Fabricantes e Importadores
- Comunicación Constante: mantén una comunicación abierta con los fabricantes e importadores de los dispositivos médicos, ya que ellos son los responsables de proporcionar información técnica actualizada y soluciones ante fallos.
- Participación en Capacitaciones: invita a los fabricantes a participar en las sesiones de formación y actualización del personal clínico y técnico sobre el uso adecuado y el mantenimiento de los dispositivos.
Conclusión
Este programa no solo debe enfocarse en el cumplimiento normativo, sino también en la mejora continua de los procesos de tecnovigilancia para garantizar la seguridad de los pacientes y la calidad en la operación de los equipos biomédicos. La participación activa de los ingenieros biomédicos y el monitoreo continuo son factores clave para el éxito de la tecnovigilancia en el entorno hospitalario.
¿Quieres mejorar la vigilancia de tus equipos biomédicos? Haz clic abajo y conoce cómo QS optimiza el monitoreo y reporte de incidentes para garantizar su seguridad


